Projekt: C01
Mitochondriale DNA an der Schnittstelle zwischen mitochondrialer Dysfunktion und Neuroinflammation beim Glaukom
Das Glaukom ist eine altersassoziierte Erkrankung, die durch den fortschreitenden Verlust retinaler Ganglienzellen (RGCs) und die Degeneration der Sehnervenfasern gekennzeichnet ist. Es stellt weltweit die häufigste Ursache für irreversible Erblindung dar. Schätzungsweise 57,5 Millionen Menschen weltweit sind vom primären Offenwinkelglaukom (POAG) betroffen, mit einer Prävalenz von 2,4 %. Ein erhöhter Augeninnendruck (IOD) gilt als Hauptrisikofaktor für die Entwicklung eines Glaukoms, und dessen Senkung ist die gängigste Behandlungsstrategie, um das Fortschreiten der Erkrankung zu verlangsamen. Allerdings entwickeln etwa ein Drittel der Patient*innen ein Normaldruckglaukom (NTG), während manche Personen mit erhöhtem IOD nie an einem Glaukom erkranken. Zudem lässt sich auch bei Patient*innen mit medikamentös gut eingestelltem IOD ein Fortschreiten der neurodegenerativen Prozesse beobachten.
Obwohl die genauen Mechanismen, die die Pathogenese des Glaukoms auslösen, bislang nicht vollständig verstanden sind, wird eine mitochondriale Dysfunktion als maßgeblicher Faktor für die Entstehung und das Fortschreiten der Erkrankung angesehen. Entsprechend konnten erhöhte Spiegel mitochondrialer DNA(mtDNA)-Mutationen sowohl bei Glaukompatient*innen als auch in experimentellen Modellen mit RGC-Verlust in Zusammenhang gebracht werden. Während bislang vor allem Defizite in der Atmungskette als Hauptursache für pathologische Veränderungen im Zusammenhang mit mitochondrialer Dysfunktion galten, hat die Entdeckung mitochondrialer schadensassoziierter molekularer Muster (mtDAMPs) die Perspektive erweitert. Diese scheinen insbesondere an der Aktivierung von Immunzellen und der daraus resultierenden Neuroinflammation beteiligt zu sein und könnten so eine zentrale Rolle in der Glaukomentwicklung einnehmen.
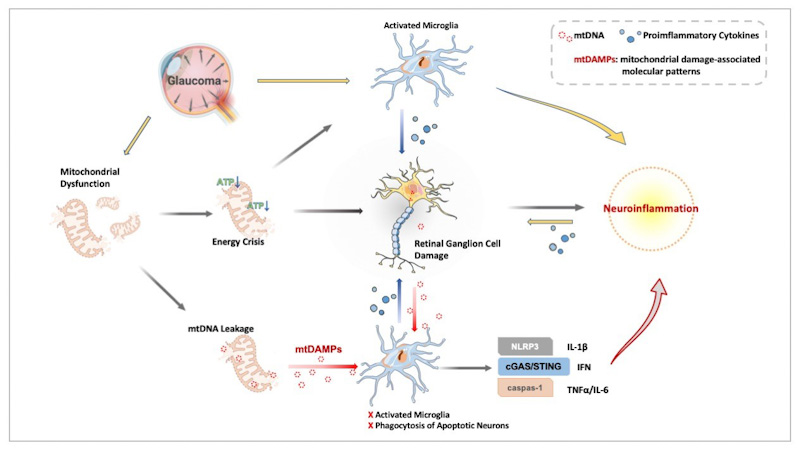
Obwohl bekannt ist, dass glaukomatöse Schäden mit mitochondrialer Dysfunktion, einer erhöhten Anzahl an mtDNA-Mutationen und Neuroinflammation einhergehen, wurde der ursächliche Zusammenhang zwischen der Anhäufung von mtDNA-Schäden und der Entstehung von Neuroinflammation beim Glaukom bislang nicht untersucht. In diesem Projekt wird die Hypothese verfolgt, dass Neuroinflammation eine zentrale Rolle bei der Glaukomerkrankung spielt und dass vermehrte mtDNA-Schäden eine Entzündungsreaktion auslösen, indem sie Mikrogliazellen in der Retina aktivieren und so die Ganglienzellen der Netzhaut (RGCs) anfälliger gegenüber äußeren Reizen machen.
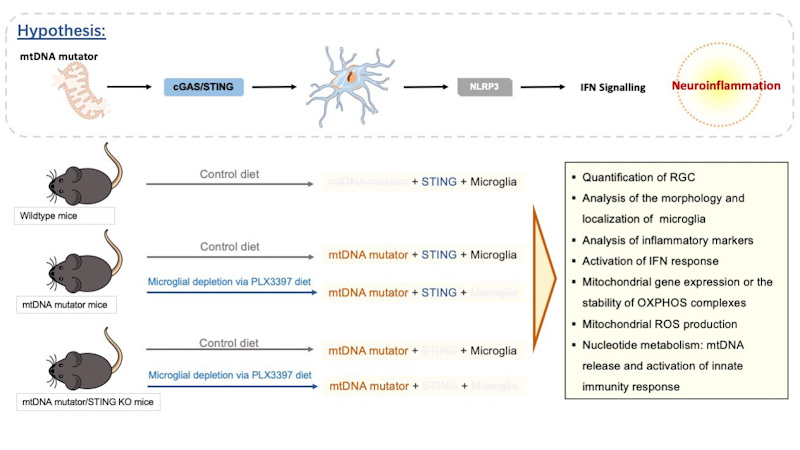
Zentrale Methoden:
• In-vivo-Modelle für transgene und induzierte Glaukome
• Immunfluoreszenzfärbung (IF)
• mtDNA-Sequenzierung
• Methoden zur Charakterisierung von Mitochondrien
• Proteomik
• Einzelzell-RNA-Sequenzierung (scRNA-seq)
• Protein- und RNA-Analysen







