Projekt: A03
Personalisierte anti-(lymph)angiogene und immunmodulierende Therapien bei Hochrisiko-Hornhauttransplantationen
Die gesunde Hornhaut ist eine gefäßfreie, transparente „Windschutzscheibe“ des Auges. Verschiedene pathologische Einflüsse – etwa chemische oder thermische Verätzungen, Infektionen, Autoimmunerkrankungen, Transplantatabstoßung, kontaktlinseninduzierte Hypoxie oder Traumata – können zu Erblindung der Hornhaut durch pathologische Neovaskularisation und Vernarbung führen. Diese Veränderungen schaffen eine sogenannte „Hochrisiko-Situation“, in der das Risiko für eine Abstoßung nach einer Hornhauttransplantation – derzeit die wichtigste Behandlungsoption bei Erblindung der Hornhaut – deutlich erhöht ist.
Wir konnten zuvor zeigen, dass klinisch unsichtbare lymphatische Gefäße in der Hornhaut entscheidend zur Entstehung einer solchen Hochrisikosituation beitragen. In einem murinen Modell der Hochrisiko-Hornhauttransplantation konnten wir zeigen, dass eine gezielte Hemmung der pathologischen (Lymph-)Angiogenese die Transplantat-Überlebensraten signifikant verbessert. Dies gelang sowohl durch pharmakologische Ansätze – etwa mittels VEGF-A/C/D-Hemmung – als auch durch mechanische Lymphangioregression, z. B. mittels feinnadelbasierter Kauterisation.
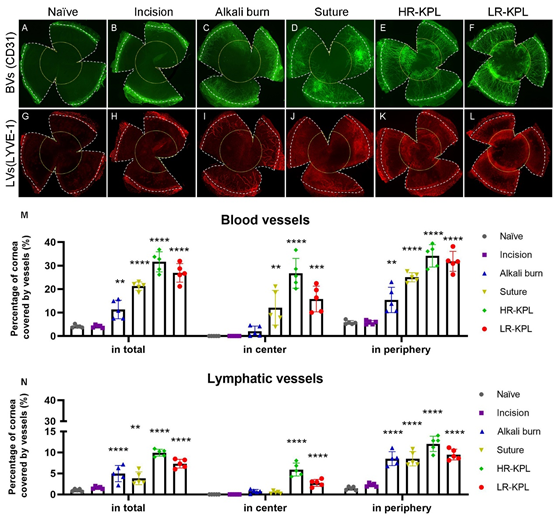
Vorläufige Daten zeigen, dass eine lymphangioregressive Vorbehandlung (z. B. durch UV-A-Crosslinking) das Transplantatüberleben bei Hochrisikoempfängern verbessern kann. Eine erste randomisierte klinische Studie (BMBF, KS2020-188) untersucht derzeit diesen Ansatz beim Menschen. Gleichzeitig deuten erste Ergebnisse darauf hin, dass unterschiedliche zugrunde liegende Hornhautschäden (z. B. Verbrennungen, Infektionen, Hypoxie) jeweils unterschiedliche immunologische und (lymph)vaskuläre Veränderungen verursachen. Dennoch erfolgt die aktuelle Therapie fast ausschließlich standardisiert mit Kortikosteroiden – unabhängig von der Ätiologie. Bisher gibt es noch keine personalisierten oder krankheitsspezifischen Therapien, die gezielt das Lymphangiogenese-Wachstum hemmen oder zurückbilden, um die unterschiedlichen Ursachen von Hochrisiko-Kornea-Transplantationen zu behandeln. Während personalisierte Medizin in der Onkologie bereits zunehmend zum klinischen Alltag gehört, hat sie in der Kornea-Transplantationsmedizin noch keinen Einzug gehalten.
Ziel dieses Projekts ist es daher, individuelle und krankheitsspezifische immunmodulatorische und lymphangiomodulatorische Behandlungsstrategien sowohl vor als auch nach Hochrisiko-Kornea-Transplantationen zu entwickeln, um das Überleben der Transplantate und die Sehfähigkeit bestmöglich zu fördern.
Darüber hinaus liegt ein besonderer Fokus auf den Auswirkungen von UV-A-Strahlung und UV-A-basierter Vernetzung (Crosslinking) auf die Transplantat-Überlebensrate. Außerdem soll durch den Einsatz künstlicher Intelligenz eine differenzierte Erkennung von Krankheitsbildern anhand von Gefäßmustern ermöglicht werden.
Forschungsziele im Einzelnen:
• Lokales immunologisches und lymphangiogenes Profiling unterschiedlicher Grunderkrankungen, die zu einer Hochrisikosituation führen.
• Entwicklung neuer krankheitsspezifischer anti(lymph)angiogener und immunmodulatorischer Behandlungsstrategien vor Hochrisiko-Transplantationen.
• Analyse des Effekts von UV-Licht und UV-basiertem Crosslinking (CXL) auf Immunzellen und pathologische Neovaskularisation in verschiedenen Hochrisikosituationen.
• KI-gestützte Analyse krankheitsspezifischer vaskulärer Signaturen und deren prädiktiver Wert für spätere Abstoßungsreaktionen (in Kooperation mit Z05).
Auf Basis dieser Arbeiten sollen maßgeschneiderte Therapieansätze entwickelt werden, die das Überleben von Transplantaten bei Hochrisiko-Patient*innen signifikant verbessern und eine personalisierte Transplantationsmedizin im Bereich der Ophthalmologie ermöglichen. Dies adressiert ein erhebliches medizinisches Versorgungsdefizit sowohl in Deutschland als auch international.
Zentrale Methoden:
• in vivo Modelle von Hornhauterkrankungen
• RNA-Sequenzierung (RNASeq)
• Proteomik
• Bioinformatik
• Cytokine Bead Arrays
• Zellkultur
• Durchflusszytometrie
• modernste Bildanalyseverfahren
• Immunfluoreszenz (IF)











