Projekt: C02
Der lymphatische Regulator SVEP1 in der Funktion des Schlemm-Kanals – ein therapeutisches Ziel bei Glaukom
Der Schlemm-Kanal (SC) reguliert den Augeninnendruck (IOD), indem er das Kammerwasser aus dem Auge ableitet. Ein erhöhter Abflusswiderstand in diesem System führt zu einem Anstieg des IOD und begünstigt die Entstehung eines Glaukoms. Der IOD ist der wichtigste Risikofaktor für die Entwicklung und das Fortschreiten dieser weltweit führenden Ursache für Erblindung. Unser Verständnis der pathophysiologischen Veränderungen, die zu einem erhöhten IOD führen, ist jedoch begrenzt. Es besteht daher ein dringender Bedarf an neuen therapeutischen Ansätzen zur Senkung des IOD.
Bislang ist unklar, welche funktionellen Veränderungen im SC für den pathologischen Druckanstieg verantwortlich sind. Erst kürzlich wurde entdeckt, dass der SC aus einer hochorganisierten, einzigartigen Gefäßstruktur besteht, die Merkmale sowohl lymphatischer als auch Blutgefäß-Endothelzellen vereint – ein sogenanntes „atypisches lymphatisches Gefäß“. Der SC selbst wird von Trabekelmaschenzellen überzogen, die zur Vorderkammer des Auges ausgerichtet sind. Dennoch konzentrieren sich die meisten Glaukomstudien auf das Trabekelwerk und weniger auf den SC. Die Untersuchung der neu entdeckten lymphatischen Eigenschaften des SC eröffnet ein neues Verständnis für die Pathophysiologie des erhöhten IOD und bietet neuartige therapeutische Angriffspunkte für verschiedene Formen des Glaukoms.
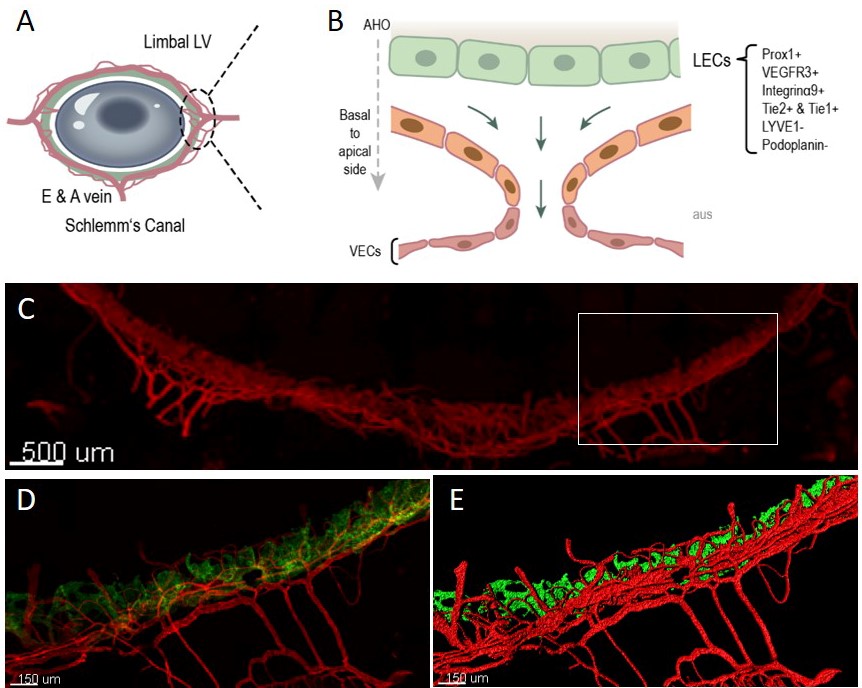
Die Doktorandin bzw. der Doktorand wird die Rolle bekannter Glaukom-Risikofaktoren in Bezug auf die Funktion des SC untersuchen. Im Fokus stehen dabei folgende Ziele:
1. Detaillierte Charakterisierung neuer präklinischer Svep1⁺/⁻- und Svep1/Tie2⁺/⁻-Mausmodelle mit erhöhtem Augeninnendruck (IOD),
2. Analyse korrelierter Veränderungen der Proteinexpression in gesundem und glaukomatösem menschlichem Gewebe,
3. Entschlüsselung des Wirkmechanismus der SVEP1-vermittelten Regulation des TIE-1/-2/ANG-Signalwegs,
4. Entwicklung einer neuen therapeutischen Behandlungs- bzw. Präventionsstrategie für das Glaukom durch Aktivierung des TIE1/-2-Signalwegs im SC mittels rekombinantem SVEP1-Protein.
Zentrale Methoden:
• In-vivo-Modelle mit transgenen Mäusen
• Morphometrische Analysen
• Immunfluoreszenz (IF)
• Zellkultur-basierte Assays
• FISH
• RNA- und Proteinanalysen
• Methoden zur Untersuchung zellulärer Signalwege
• Präklinische Testverfahren







